RNA結合蛋白(RNA binding protein,RBP)是一類功能強大而廣泛的調節因子,約占細胞編碼的所有蛋白的5%-10%。目前除了少數RNA以核酶形式單獨發揮功能,大部分RNA通過與蛋白結合形成RNA-蛋白復合物來發揮作用。
目前研究RNA-蛋白質相互作用的方法分為兩大類:一是以感興趣的RNA為中心,尋找與該RNA結合的蛋白質;二是以感興趣的蛋白質為中心,尋找與該蛋白質結合的RNA。RNA pulldown屬于前者,通過體外轉錄的方式將感興趣的RNA帶上標簽,通過該標簽使RNA結合到樹脂支持物上,再加入樣本蛋白質與RNA結合,洗滌、洗脫得到與目標RNA結合的蛋白質。
由于RNA pull down、RIP-Seq這些技術主要是用于篩選的,因此后續一般也要通過WB、PCR或者qPCR等進行驗證。
RNA pull down是體外條件下尋找目標RNA的結合蛋白的方法。使用體外轉錄法標記生物素RNA探針,將體外轉錄的RNA結合到Beads上,再將RNA-Beads和細胞裂解液孵育,這樣與目標RNA結合的蛋白便會一起吸附在Beads上。
洗滌掉不結合的蛋白后,用洗脫液將RNA-蛋白復合物從Beads洗脫下來,即RNA pull-down產物。該復合物可與鏈霉親和素標記的磁珠結合,從而與孵育液中的其他成分分離。
這種互作復合物既可以用Western Blot檢測特定的結合蛋白,還可以采用質譜方法鑒定與目標RNA結合的未知蛋白。
實驗大致流程:RNA探針制備→總蛋白提取→磁珠預處理→RNA PullDown(磁珠-RNA探針復合物富集互作的蛋白)→蛋白洗脫→WB檢測是否存在靶蛋白/質譜鑒定洗脫液中的蛋白
1 RNA探針制備
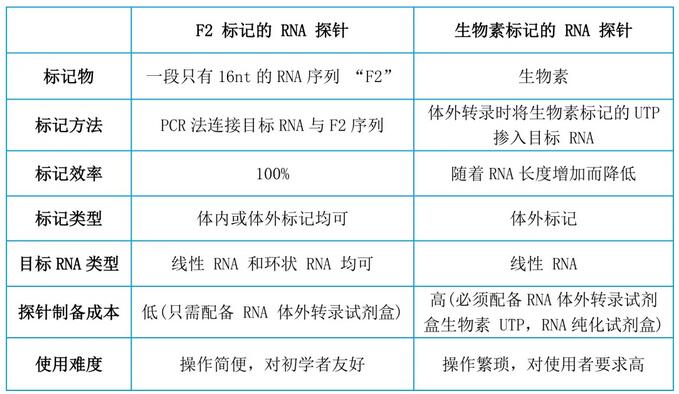
目前,體外RNA探針主要采用生物素標記,操作復雜且成本高。輝駿生物自主研發了一種用RNA標簽“F2”來標記目標RNA探針的方法(已申請專利,已有文獻引用),使標記更簡單,成本更低。以下詳細介紹下兩種標記方法。
1.1 生物素標記的RNA探針制備
(1)構建RNA過表達質粒:基因合成+測序驗證;
(2)體外轉錄模板準備:根據目標RNA序列設計帶有T7啟動子(TAATACGACTCACTATAGGG)的引物,以目標序列的DNA質粒為模板,PCR分別獲得T7-正義RNA(實驗組)和T7-反義RNA(對照組)轉錄模板,按照DNA凝膠回收試劑盒說明書要求回收純化目標DNA;
(3)體外轉錄:以上述DNA為模板,加入相應的RNA體外轉錄配置的反應體系(含生物素UTPs),37℃孵育2 h,再加入1 μL DNase I,37℃孵育15 min將DNA模板消化,得到正義和反義RNA;
(4)為了避免轉錄產物中的游離生物素UTP 競爭結合磁珠,此處最好采用 RNA 純化試劑盒來處理轉錄產物,但此操作可能造成一定的產物損失,可以根據具體情況決定是否進行此步操作;
(5)使用Nanodrop(紫外分光光度計)檢測RNA濃度,取1-2 μL RNA進行2%瓊脂糖凝膠電泳檢測RNA質量和長度;符合要求的 RNA 置于- 80℃保存或直接用于后續實驗。
1.2 F2標記的RNA探針制備
(1)操作方法與生物素標記的RNA探針類似,但在制備DNA模板時,需要將17bp的F2序列一起加入到引物中。RNA體外轉錄體系則無需再加入生物素UTPs,節省了成本,后續也不需要進行RNA純化操作,簡化了操作步驟。
(2)以上述DNA為模板,加入相應的RNA體外轉錄配置的反應體系(無需再加生物素UTPs),37℃孵育2 h,再加入1 μL DNase I,37℃孵育15 min 將DNA模板消化,得到正義和反義RNA。
圖2 F2標記的RNA探針與生物素標記的RNA探針對比圖1??由于RNA容易降解,最好在RNA pull-down實驗當天或前一天進行體外轉錄實驗;2??當目標序列過短(<300bp)或過長(>4kb)時,探針制備難度將增加;長序列可以分段進行實驗。
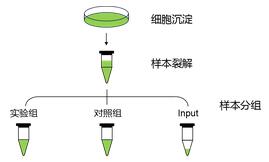
2 總蛋白提取
2.1 細胞樣本
(1)培養目標細胞,待細胞生長至合適密度,收集細胞;
(2)用預冷PBS緩沖液清洗細胞2-3次,加入0.6-1 mL預冷的裂解緩沖液(輝駿貨號:FI8101),在裂解液中預先加入6-10 μL蛋白酶抑制劑(輝駿貨號:FI8105)、3-5 μL RNA酶抑制劑(輝駿貨號:FI8106),現用現配;
(3)4℃混勻儀上裂解30 min或者冰上超聲至溶液基本澄清(如果無超聲條件,可置于冰上裂解30 min,期間每10 min渦旋混勻一次,每次5 s);
(4)4℃離心機12000 rpm離心15 min,收集上清至新的1.5 mL無RNase EP管中;
(5)取30 μL作為input,剩余上清平分為兩份用于RNA pull-down實驗(記為實驗組和對照組),置于冰上備用或-80℃保存。
2.2 組織樣本
(1)采用預冷的PBS清洗新鮮組織,去除血液等成分;
(2)實驗組和對照組分別取0.2-0.4 g干凈的組織,用液氮在研缽中充分研磨,隨后轉移至預冷的無RNase、新的EP管中;
(3)將樣本置于冰上,加入0.6-1 mL預冷的裂解緩沖液,在裂解液中預先加入6-10 μL蛋白酶抑制劑、3-5 μL RNA酶抑制劑,吹打混勻,現用現配;
(4)4℃混勻儀上裂解30 min或者冰上超聲至溶液基本澄清;
(5)4℃離心機12000 rpm離心15 min,收集上清至新的1.5 mL無RNase EP管中;
(6)取30 μL作為input,剩余上清平分為兩份用于RNA pull-down實驗(記為實驗組和對照組),置于冰上備用或- 80℃保存。
3 磁珠預處理
(1) 將鏈霉親和素磁珠(輝駿貨號:FI8303)上下顛倒混勻,取實驗組和對照組一共所需的80 μL 磁珠到新的無RNase EP管中;
(2) 加入1 mL NT2緩沖液,顛倒混勻30次,放磁力架上靜置1 min 并棄上清;
(3) 重復上步操作一次;
(4) 加入400 μL NT2緩沖液,上下顛倒重懸磁珠;
(5) 將磁珠平分為兩份,每組各約200 μL,轉移到新的無 RNase EP管中,記為實驗組和對照組。
4 RNA pull-down
(1) 取實驗組和對照組RNA探針各3 μg,95℃加熱變性3 min,冰浴1 min,瞬離,向管中加入50 μL RNA結構緩沖液,室溫放置30 min;
(2) 將RNA探針分別加入對應的磁珠中,混勻儀上室溫孵育30 min;
(3) 放磁力架上靜置1 min,并棄上清;
(4) 每組加入500 μL漂洗液,顛倒混勻30次,放磁力架上靜置1 min,并棄上清;
(5) 重復上步操作一次;
(6) 加入相應組別的樣本裂解液,混勻儀上4℃孵育2~4 h;
(7) 放磁力架上靜置1 min 并棄上清;
(8) 每組加入 500 μL 漂洗液,顛倒混勻30次,放磁力架上靜置1 min 并棄上清;
(9) 重復上步漂洗操作兩次,共漂洗三次,保留磁珠。
5 蛋白洗脫
5.1 變性洗脫
(1)向磁珠中加入50 μL 1×SDS-PAGE上樣緩沖液進行洗脫,振蕩混勻后瞬離,95℃加熱5-10 min;
(2)放磁力架靜置1 min,收集上清至新的1.5 mL EP管中,進行SDS-PAGE或Western Blot檢測,如果需要進行質譜檢測,則切膠條后送檢。
5.2 非變性洗脫
(1)向磁珠中加入50 μL洗脫緩沖液(輝駿貨號為:FI8102),渦旋振蕩20 s,放混勻儀上室溫洗脫10-15 min,渦旋振蕩20 s;
(2)1000 g離心20 s,放磁力架上靜置1 min,收集上清至新的1.5 mL EP管中;
(3)洗脫后的蛋白-80℃保存,或直接用于SDS-PAGE、Western Blot和質譜等實驗。
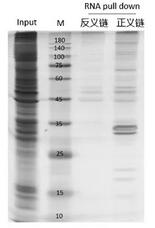
1??如果選擇非變性洗脫法,可以暫時保留洗脫后的磁珠,當非變性洗脫效率較低時,則采用變性洗脫法繼續洗脫蛋白。2??RNA pull-down捕獲的蛋白量通常較少,因此SDS-PAGE膠建議用硝酸銀染色,檢測富集蛋白的情況。
6 WB檢測是否存在靶蛋白/質譜鑒定洗脫液中的蛋白
6.1 WB檢測是否存在靶蛋白
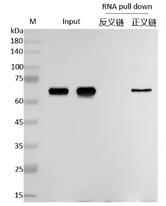
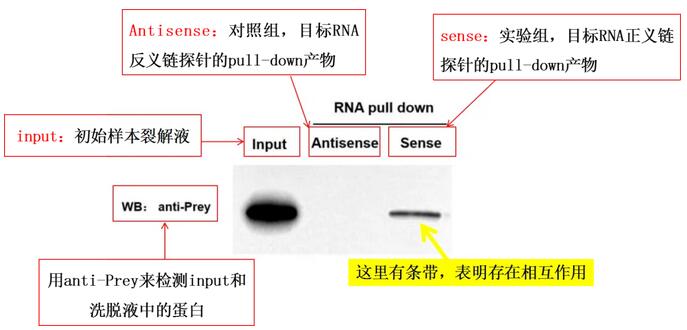
通過蛋白印跡(Western Blot)技術使用Anti-Prey對沉淀中的蛋白質進行檢測,若能夠檢測在目標RNA沉淀中有清晰Prey條帶,則說明存在特異性相互作用。
圖4 RNA pull down WB檢測圖(陽性)6.2 質譜鑒定洗脫液中的蛋白
通過質譜鑒定實驗組與對照組的差異蛋白,進而篩選可能的互作蛋白。
圖5 RNA pull down MS產物銀染膠圖
Input組(陽性對照組):樣本裂解液;
Antisense(對照組):目標RNA反義鏈探針的pull-down產物;
Sense(實驗組):目標RNA正義鏈探針的pull-down產物。
先看Input組:驗證Input組需檢測到待測蛋白(Prey)條帶。若Input組無信號,說明樣本中待測蛋白未提取成功或濃度過低,后續Sense組和 Antisense組的結果無意義,需重新優化蛋白提取步驟。
再比較Sense組與Antisense組:判斷特異性相互作用。若Sense組檢測到待測蛋白(Prey)條帶,且Antisense組無條帶或條帶極弱,說明目標RNA正義鏈能特異性結合待測蛋白,可判定二者存在相互作用。
RNA pulldown實驗驗證目標RNA與待測蛋白(Prey)是否存在相互作用,如果最終的結果Sense組有條帶,則可以證明之間存在相互關系。上圖為RNA pull-down陽性結果示意圖:表明目標RNA可以與Prey蛋白結合,存在相互作用。
?注意:
1??如果Sense組與Antisense組均檢測到明顯的待測蛋白信號:說明存在非特異性結合(如探針與蛋白的非特異吸附),需優化實驗條件(如增加洗滌次數、調整探針濃度、用5%BSA封閉磁珠)后重新驗證。2??如果Sense組與Antisense組均未檢測到待測蛋白信號:需先確認Input組是否有信號,若Input組有信號則可能是探針與蛋白結合效率低(如探針標記失敗、孵育條件不當),需排查探針制備或孵育步驟。
1 RNA pull down試劑盒
2 RNA pull down實驗服務
如果您在做RNA pulldown實驗上還有疑問,歡迎咨詢我們的技術人員:400-699-1663。
輝駿生物還提供各種類型蛋白互作試劑盒以及互作實驗服務(IP、RIP、RNA pull down、ChIP、DNA pull down實驗),可根據實驗需求定進行選擇,助力您的科研更高效、更精準!











 實驗熱線:4006991663
實驗熱線:4006991663