中文標題:MYPT1/ pp1介導的EZH2 S21去磷酸化通過控制多個基因家族促進纖維化的上皮-間質轉化
發表期刊:Adv Sci (Weinh)
影響因子:17.521
發表時間:2022年3月
合作單位:中山大學中山眼科中心
運用技術:LC-MS/MS蛋白質譜鑒定(由輝駿生物提供技術支持,點擊查看服務詳情)
內容概述:
2022年3月,輝駿生物的合作伙伴——中山大學中山眼科中心團隊在期刊Advanced Science(IF2022=17.521)上發表題為“MYPT1/PP1-Mediated
EZH2 Dephosphorylation at S21 Promotes Epithelial-Mesenchymal
Transition in Fibrosis through Control of Multiple Families of Genes
“的文章。實驗發現甲基轉移酶EZH2在晶狀體中高表達,AKT-EZH22通路在TGF-β誘導的上皮-間質轉化(EMT)中非常重要。質譜分析結果顯示,MYPT1/PP1能使EZH2-S21去磷酸化。這些結果確定了EZH2-S21的特異性磷酸酶,并揭示了EZH22去磷酸化控制的、與晶狀體EMT和眼睛前囊下白內障(ASC)發病相關的幾個基因家族。
研究背景:
EZH2是多梳抑制復合物2(PRC2)中發揮甲基轉移酶活性的核心成員,可以催化H3K27Me3,進而抑制下游基因轉錄。此外,EZH2還可以作為獨立于PRC2復合物的非組蛋白甲基轉移酶,甲基化轉錄因子和其他靶標。蛋白磷酸化在EZH2功能開關中起著重要作用。已知AKT激酶可以介導EZH2-S21磷酸化來抑制其H3K27Me3催化功能。然而,負責EZH2-S21去磷酸化的酶仍然未知。
研究路線:
WB和IF檢測發現AGS小鼠模型和患者中的EZH2-S21磷酸化與EMT有關生長RNA干擾實驗確定AKT磷酸化EZH2-S21來介導TGF-β誘導的晶狀體上皮細胞EMTCo-IP MS和敲除實驗發現并證實MYPT1-PP1使EZH2-S21去磷酸化來抑制EMTEZH2-S21突變表達、轉錄組分析和ChIP-seq確認EZH2-S21去磷酸化調控的下游基因RNA干擾和基因敲除實驗證實EZH2-S21去磷酸化通過POSTN基因促進EMT和ASC細胞、小鼠模型和患者檢測證實EZH2-S21磷酸化狀態調控了EMT相關基因表達和AGS病變
研究結果:
1. EZH2在晶狀體上皮細胞中高表達且其活性和S21磷酸化水平隨EMT而增強
為了解EZH2在晶狀體中的作用,Western
blot(WB)檢測了3周齡和成年小鼠晶狀體上皮細胞和纖維細胞中的EZH2和EZH2-S21磷酸化(p-EZH2
S21)水平,結果顯示:EZH2在3周齡和成年上皮細胞中均高表達,p-EZH2
S21在成年上皮細胞中的水平顯著高于3周齡小鼠,EZH2和p-EZH2 S21在成年纖維細胞中幾乎檢測不到(圖1A,B)。
正因為EZH2在小鼠晶狀體中高表達,因此推測其可能參與ASC上皮細胞的EMT進程。對患者和小鼠模型的ASC斑塊進行IF和WB分析,發現AKT活性和p-EZH2
S21水平顯著高于對照(圖1C-E)。低活性的EZH2(表現為較高的p-EZH2-S21和較低的H3K27me3)伴隨著為高水平的EMT標記物(FN和α-SMA)(圖1E)。
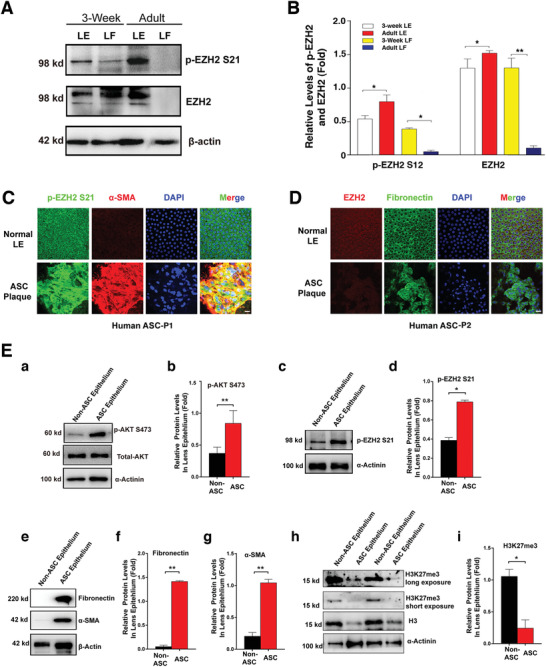
圖1
2. TGF-β激活AKT-EZH2-H3K27Me3通路來介導晶狀體上皮細胞中的EMT
為了確定AKT是否也能磷酸化EZH2-S21來調節晶狀體細胞的EMT,作者首先用TGF-β處理人晶狀體上皮細胞系HLE
48小時,建立了EMT模型,接著用AKT活性抑制劑來封閉AKT的活性,這使得p-EZH2
S21減弱,H3K27Me3增強,并且消除了TGF-β誘導引起的EMT標記物FN1和α-SMA的水平增加;AKT1和AKT2的敲低也得到了類似結果(圖2A-G)。這表明AKT能調控EZH2-S21磷酸化,介導TGF-β誘導的晶狀體上皮細胞EMT。
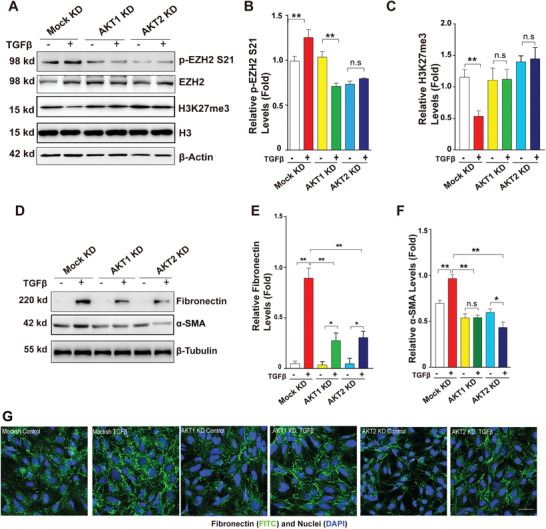
圖2
3. MYPT1-PP1使EZH2-S21去磷酸化
那么是哪個蛋白酶去磷酸化EZH2-S21呢?作者利用OA(PP1和PP2A的有效抑制劑)處理HLE細胞,發現OA劑量依賴性的增加了p-EZH2
S21水平(圖3A-B)。免疫共沉淀質譜(Co-IP
MS)分析發現EZH2的結合蛋白除了有PRC2的其他組分SUZ12、EED和RBBP4之外,還有PP1調節亞基PPP1R12A(也稱為MYPT1),這引起了作者的注意。Co-IP
WB和IF實驗進一步確定了EZH2和MYPT1間的相互作用(圖3C-F)。
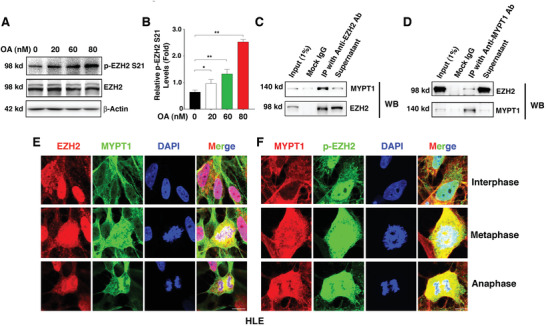
圖3
4. MYPT1敲除增強了晶狀體上皮細胞EMT
為了證實MYPT1-PP1通過去磷酸化EZH2影響晶狀體上皮細胞的EMT進程,作者采用CRISPR/Cas9技術敲除HLE細胞中的MYPT2,發現p-EZH2
S21增強,H3K27Me3水平下降(圖4A-C),并且TGF-β誘導的EMT顯著增強(圖4D-G)。MYPT2和EZH2沉默的斑馬魚突變體也表現出嚴重的心臟水腫、脊柱彎曲和小眼等表型,眼部組織中的EMT標志物(FN1a,
LAMC2和MMP9)也顯著上調。這些結果表明,MYPT1-PP1可以使EZH2去磷酸化,激活其甲基轉移酶活性,并在體外和體內調節EMT。
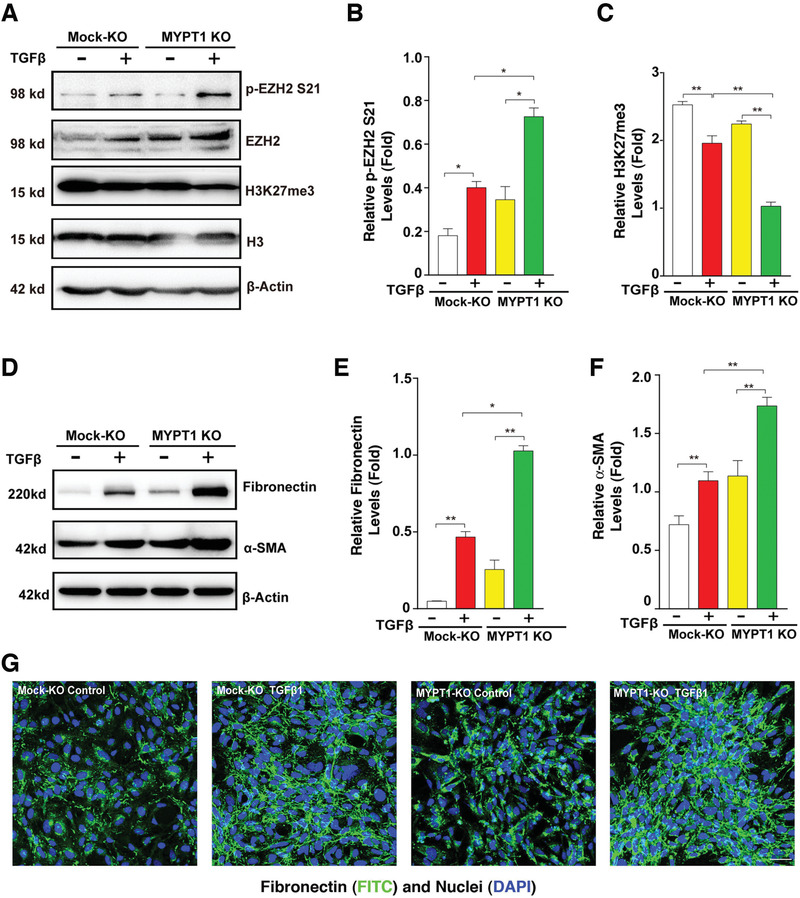
圖4
5. 內源性EZH2-S21突變抑制了TGF-β誘導的EMT
為了進一步確定EZH2-S21磷酸化能否從功能上控制EMT進程,作者采用EZH2野生型和EZH2-S21突變型(絲氨酸突變成賴氨酸)慢病毒分別感染HLE細胞構建穩轉細胞株(圖5A-C),WB和IF分析證實,相比于空載對照,它們的表達均顯著抑制了TGF-β誘導的EMT標志物上調(圖5D-G)。
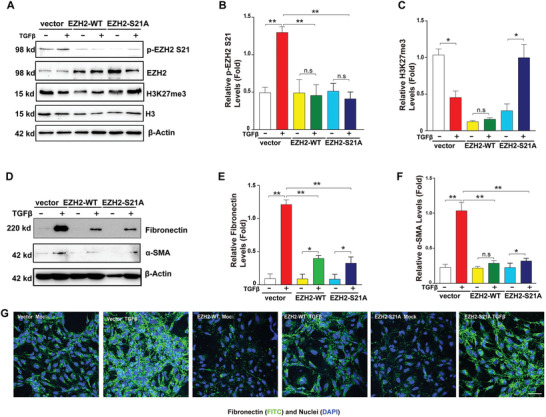
圖5
6. EZH2去磷酸化調控多個EMT相關的基因家族
為了找到EZH2去磷酸化調控的下游基因,作者對EZH2野生型、EZH2-S21突變型和空載對照細胞株進行了轉錄組分析,
GO分析結果顯示很多差異基因屬于細胞外基質基因和細胞粘附基因;之后又在敲除了內源EZH2的細胞中再表達EZH2野生和EZH2-S21突變體,并用TGF-β處理。qPCR檢測了轉錄組篩選出的差異基因,確定了三個參與EMT調控的基因家族——膠原基因、細胞外基質基因和細胞粘附基因(圖6A-D)。為了進一步證實EZH2去磷酸化調控了這3個基因家族,選取了3個主要靶基因Col1A1、MMP17和POSTN進行ChIP-seq,發現TGF-β處理的HLE細胞中的H3K27me3水平遠小于未處理組(圖6E)。
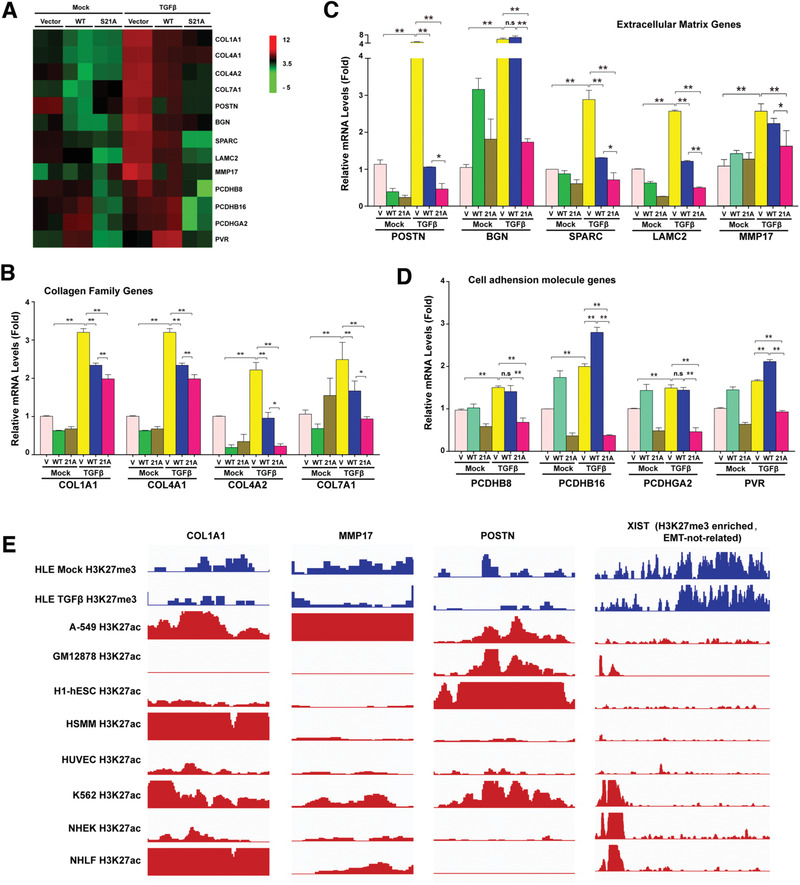
圖6
7. EZH2-S21磷酸化調控POSTN基因來促進TGF-β誘導的EMT和ASC
為了進一步確定上述EMT相關基因家族確實受EZH2-S21去磷酸化控制并參與EMT和AGS病變,研究者利用慢病毒構建EZH2沉默的HLE細胞系,再此基礎上分別進行EZH2過表達、EZH2-S21A過表達和EZS2-S21D過表達(圖7A-C)。qPCR檢測發現POSTN在EZS2-S21D細胞中的豐度最高(圖7D)。使用CRISPR/Cas9技術(圖7E)或shRNA(圖7F)敲除MYPT1可顯著增加POSTN
mRNA水平,在MYPT1突變的斑馬魚眼睛中也觀察到POSTN的表達增強。
在POSTN沉默細胞中,TGF-β處理組的EMT標記物(FN、COL1A1、SNAI1和SNAI2)水平均顯著低于非沉默細胞(圖7G-J)。在POSTN基因敲除小鼠中,ASC的誘導受到限制,EMT標志物(FN、COL1A1)的表達也顯著降低(圖7K-M)。在患者ASC斑塊中,POSTN也高表達(圖7N)。
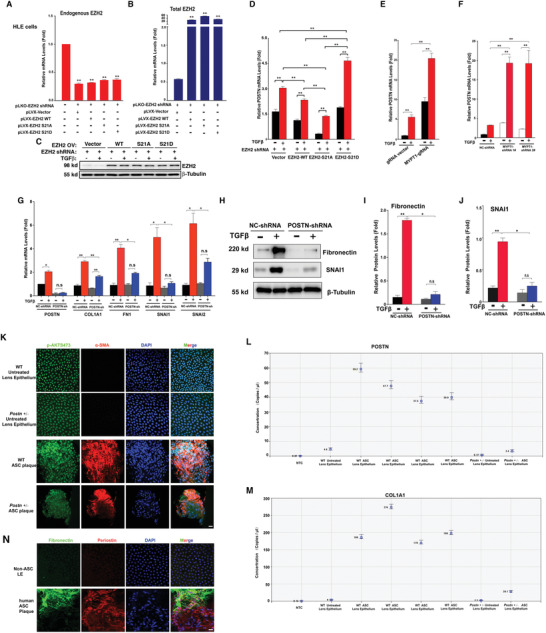
圖7
8. MYPT敲除促進了EMT相關基因表達和AGS病變
為了進一步確定EZH2-S21去磷酸化直接控制的EMT相關基因,研究者用TGF-β處理MYPT敲除細胞或未敲除細胞,qPCR方法檢測發現SPARC、BGN、PCDHB8、PCDHB16、COL1A1、COL4A1、COL4B2和COL7A1的水平顯著高于對照(圖8A)。在ASC小鼠模型(圖8B)和人類ASC患者(圖8C)中也得到了相似結果,表明這些由EZH2-S21去磷酸化控制的EMT相關基因顯著促進了ASC病變。
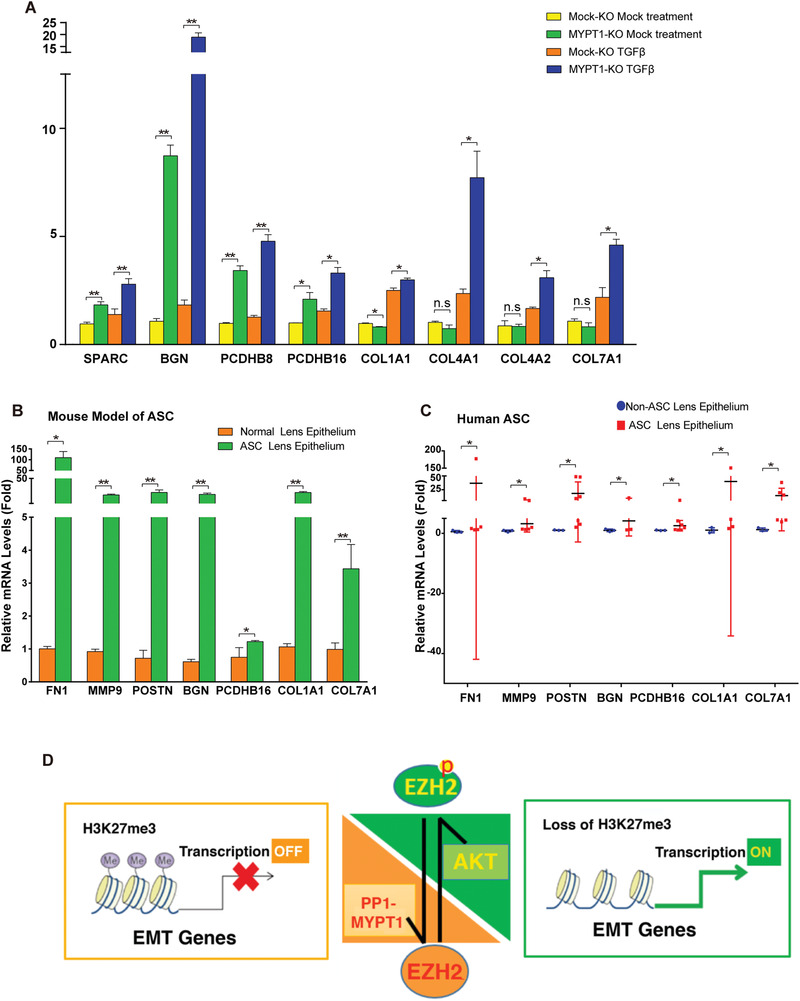
圖8
研究結論:
該研究不僅確定了AKT激活EZH2-H3K27Me3來調控TGF-β誘導的晶狀體上皮細胞EMT,而且發現了MYPT1-PP1可使EZH2-S21去磷酸化,進而調控3個EMT相關基因家族參與ASC病變(圖8D)。









 實驗熱線:4006991663
實驗熱線:4006991663











